Квантовая химия. Введение.
Contents
Квантовая химия. Введение.#
Автор(ы):
Описание лекции#
Из этой лекции узнаем:
что такое квантовая химия, что с ее помощью можно сделать, а что – нельзя;
как устроена самая простая теория, описывающая квантовую физику атома;
какие у этой теории есть ограничения.
Введение#
В предыдущих лекциях говорили о применении квантовой механики для вычислений и обработки информации. Однако, исторически квантовая теория развивалась в первую очередь из-за того, что классическая физика не могла объяснить некоторые наблюдаемые эффекты: дискретный спектр излучения атомов, фотоэффект в металлах, интерференцию частиц на дифракционных щелях.
Считается, что квантовая механика дает полное и точное описание состояния и эволюции любой системы при нерелятивистских условиях – по крайней мере, на сегодняшний день этому нет экспериментальных или теоретических противоречий. Это значит, что в теории возможно для любой системы частиц записать уравнения Шредингера, решить их и предсказать, как себя поведет система. Между тем, на практике оказывается, что в реальных задачах вроде моделирования лекарств и материалов, просто “взять и посчитать” – задача весьма сложная, а иногда – неразрешимая.
Проблемами применения квантовой механики к химии и материаловедению занимается квантовая химия. Она делает это уже около 100 лет, по теме написаны толстые книжки с многоэтажными формулами, так что в лекции будут даны основы и простые примеры без полного вывода.
Предполагается, что читатель знаком с уравнением Шредингера и основными операторами (импульса, эволюции), бра-кет нотацией, а также помнит основы физики и химии на уровне старших классов школы.
Атом водорода#
В чем проблема?#
Спектр излучения и поглощения атомов – то есть на какой длине волны происходит поглощение и излучение света веществом – был одной из первых “нерешаемых” проблем, приведших в итоге к появлению квантовой физики. Для простых веществ в газообразной форме спектр является дискретным, и для атома водорода спектры поглощения и излучения в видимом диапазоне выглядят так:
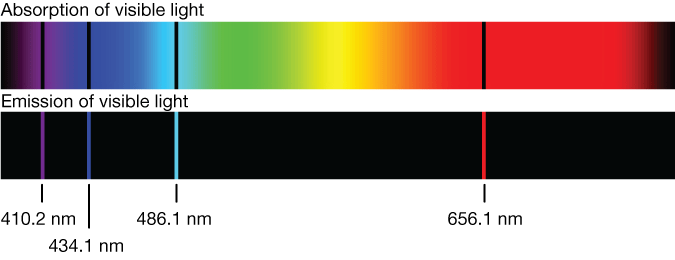
Fig. 84 Спектр поглощения и излучения водорода в видимом диапазоне#
В конце 19 века было уже известно, что атом водорода состоит из двух заряженных частиц – протона и электрона, но из классической физики следовало, что спектр излучения такой системы должен быть непрерывным, что никак не стыковалось с наблюдениями (дискретные линии на графике). Попробуем вслед за исследователями квантовой физики начала 20 века разобраться с этой проблемой.
Про имена
“Квантовая физика” и “квантовая механика” – связанные понятия, но не тождественные.
Квантовая механика – это теория (а точнее, множество теорий с различающимися терминологиями), в основе которой лежит аксиоматика о том, что сущности описываются волновыми функциями, что они эволюционируют и, что зная эти функции, можно посчитать физические величины – например, энергию.
Квантовая физика – это область физики, исследующая квантовые эффекты, при этом она местами может не иметь строгого обоснования – лишь бы предсказания работали.
С квантовой химией тоже есть некоторая путаница – в двадцатом веке под ней имели в виду аналитические и численные методы решения задач квантовой механики применительно к молекулам и кристаллам. Но с развитием квантовых компьютеров эту область стали иногда называть вычислительной химией, а квантовой химией – применение квантовых компьютеров к этой области.
Быстрое и неправильное решение#
Первой теорией в квантовой физике была “Боровская теория” – почти классическая теория, основанная на постулатах, разрешающих противоречия классической физики с экспериментами на уровне “хардкода”. Главный постулат заключается в том, что момент импульса может принимать только определенные дискретные значения (кванты), а не произвольные:
и отсюда
где \(p = mv\) – импульс электрона, \(r\) – радиус орбиты электрона, \(\hbar\) – постоянная Планка, \(n\) – любое целое число. Если применить этот постулат к атому водорода – паре из протона и электрона, то получится, что:
электрон вокруг протона “летает по орбите”;
спектр (уровни энергии электрона) – дискретный.
Можно показать это следующим образом.
Во-первых, поскольку частиц две и протон имеет массу много больше массы электрона, можно перейти в почти инерциальную систему отсчета протона, где он неподвижен, и решить задачу только для электрона.
Из классической механики берем теорему о вириале (“для стабильной системы из двух частиц, связанных потенциальными силами, в среднем кинетическая энергия равна половине потенциальной”):
Записываем кинетическую энергию и потенциал Кулона для электрона в поле протона (в СИ):
где \(k\) – постоянная из закона Кулона.
Используем постулат Бора и выразим “радиус” орбиты:
Находим полную энергию:
Уровни энергии пропорциональны \(\frac{1}{n^2}\) и именно такая зависимость наблюдается в эксперименте.
Посчитаем минимальную энергию (\(n = 1\)):
from scipy import constants as consts
# постоянная кулона
k = (1 / (4 * consts.pi * consts.epsilon_0))
# энергия в Джоулях
E1 = - k**2 * consts.m_e * consts.e**4 / (2 * consts.hbar ** 2)
# энергия в электрон-вольтах
E1_ev = E1 / consts.e
print(f"Hydrogen Bohr ground state energy: {E1_ev} eV")
Hydrogen Bohr ground state energy: -13.605693122885837 eV
Получившийся ответ (13.6 eV) в точности совпадает с экспериментальным значением энергии ионизации водорода.
Итого: постулировав несколько очень удачных гипотез (главная – что момент импульса квантуется, то есть принимает только дискретные значения), удалось разрешить фундаментальную нестыковку между классической теорией и экспериментом: энергия стала дискретной, линии спектра (длины волн) стали обратно пропорциональны \(\left( \frac{1}{n_{final}^2} - \frac{1}{n_{initial}^2} \right)\), значения энергии ионизации совпадают с реальными измерениями.
Казалось бы, замечательно, проблема решена! Однако теория Бора имеет ряд проблем. Главная из них заключается в том, что теория работает только для “водородоподобных” атомов, то есть состоящих из ядра и одного электрона на внешней оболочке. Уже для атома гелия спектр не согласуется с боровской теорией.
Кроме того, с точки зрения науки, теория Бора – это в некоторым смысле “читерство”. Выбрав удачные постулаты и подставив соответствующие формулы в законы классической физики, получили правильный результат. Но будь постулаты другими, результат получился бы тоже другой, так что фактически постулаты Бора – это гениальная догадка, позволившая угадать правильные результаты для некоторых систем.
